Balance de exergía en sistemas abiertos y cerrados
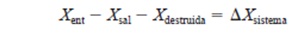
La naturaleza de la exergía es opuesta a la de la entropía, en la cual la exergía puede destruirse pero no puede crearse. Por consiguiente, el cambio de exergía de un sistema durante un proceso es menor que la transferencia de exergía por una cantidad igual a exergía destruida dentro de las fronteras del sistema durante el proceso. Entonces el principio de disminución de exergía puede expresarse como Esta relación se conoce como el balance de exergía y puede definirse como: el cambio de exergía de un sistema durante un proceso es igual a la diferencia entre la transferencia neta de exergía a través de la frontera del sistema y la exergía destruida dentro de las fronteras del sistema como resultado de las irreversibilidades. Un sistema cerrado no involucra flujo másico, por lo tanto tampoco cualquier transferencia de exergía asociada con el flujo másico. Si se toma la dirección positiva de la transferencia de calor hacia el sistema y la dirección positiva de transferencia de...

